Arsenic hay Asen trong các phim cổ trang còn gọi là thạch tín dùng để hạ độc. Từ rất lâu, con người đã biết tới Arsen và độc tính của nó.
Tìm hiểu về Arsenic (Ansen)
Theo 1 số nghiên cứu cho thấy, arsen là 1 chất cực độc, gấp 4 lần so với thủy ngân. Mặc dù trước đây, người ta vẫn dùng Arsen 1 cách thông dụng trong công nghiệp khai mỏ,luyện kim,thuốc trừ sâu,thuốc diệt cỏ,thậm chí trong 1 số chất tăng trọng cho gia súc.
Arsen vào cơ thể con người chủ yếu thông qua con đường hô hấp và tiêu hóa, đặc biệt thông qua việc sử dụng nước ngầm bị ô nhiễm Arsen. Arsen có thể gây ra các bệnh kinh niên như u hắc tố, ung thư biểu bì, hoại thư da…Nó đã gây ra những đợt nhiễm độc do tích tụ Arsen lớn nhất trong lịch sử loài người (ở Bangladesh). Theo nghiên cứu ở Nhật Bản, qua các xét nghiệm lâm sang đã cho thấy, trong số 29 người uống nước giếng bị ô nhiễm Arsen có 23 người (93%) có biểu hiện nhiễm hắc tố (melanosis) và 22 người (26%) mắc bệnh tăng sừng hóa bẩm sinh gan bàn chân (palmoplantar hyperkeratoris).
Ở Việt Nam, nước tại 1 số khu vực lớn và đông dân cư sinh sống như Hà Nội, Việt Trì-Lâm Thao, thượng nguồn sông Mã…có hàm lượng Arsen vượt quá tiêu chuẩn cho phép, thậm chí có nơi vượt hơn 10 lần so với TCVN (hàm lượng Arsen cho phép trong nước sinh hoạt của VN là 0,05mg/l). Do ở Việt Nam, một số lượng lớn người dân còn sử dụng nước uống, nước sông suối để sinh hoạt, ăn uống nên vấn đề ô nhiễm Arsen thật sự rất cấp bách. Với việc sử dụng nước phức tạp như hiện nay,cũng như việc ô nhiễm Arsen tiềm ẩn chưa phát hiện được hay chưa khảo sát được thì việc nhiễm độc tiềm tàng rất có thể xảy ra. Đặc biệt, càng nguy hiểm hơn khi hiện nay, hầu hết các bệnh gây ra bởi nhiễm độc Arsen vẫn chưa có thuốc đặc trị.
Để giải quyết những yêu cầu vô cùng cấp bách trong việc xử lí ô nhiễm Arsen trong nguồn nước, chúng ta phải có sự hiểu biết cặn kẽ về chu trình hóa học của Arsen trong tự nhiên để đưa ra những biện pháp thích hợp nhằm ngăn chặn và hạn chế việc ô nhiễm Arsen trong nguồn nước.
Một số tính chất của Arsenic
An chiếm 1.10-4 % tổng số nguyên tử trong vỏ trái đất, chúng tồn tại chủ yếu ở dạng khoáng vật sunfua: Sunfide Orpiment vàng – As2S3 và Realgar đỏ – As4S4;…
Trong bảng hệ thống tuần hoàn các nguyên tố hoá học, Arsenic nằm ở phân nhóm Va với một số các đặc trưng:
Bảng Tính chất hóa học của nguyên tử Arsenic.
| Ký hiệu hoá học | As |
| Z | 33 |
| Cấu hình e | [Ar]3d104s24p3 |
| Rn/tử (AO) | 1,48 |
| Rion E3- (AO) | 1,92 |
| Rion E5+ (AO) | 0,47 |
| Eion hòa I (kcal/ntg) | 226 |
| Eion hòa II (kcal/ntg) | 466 |
| Eion hòa III (kcal/ntg) | 653 |
| Độ âm điện | 2,0 |
| Khối lượng riêng (g/cm3) | 5,727 |
| TOnc(OC) | 817 |
| TOs (OC) | 614 |
As tồn tại ở hai dạng kim loại và không kim loại:
Ở dạng không kim loại, As là chất rắn màu vàng (còn gọi là As vàng) được tạo nên khi làm ngưng tụ hơi, có mạng lưới lập phương (giống Photpho trắng), kiến trúc mạng lưới bao gồm các phân tử As4 liên kết với nhau bằng lực Vanderwaals. Phân tử As4 có cấu tạo hình tứ diện đều với các nguyên tử As nằm ở đỉnh. Do có mạng lưới phân tử nên As vàng kém bền ở nhiệt độ thường dưới tác dụng của ánh sáng dễ chuyển sang dạng kim loại (dạng bền hơn).
Dạng kim loại có màu bạc trắng, hơi xám (gọi là As xám). As xám có cấu trúc dạng Polime, có mạng lưới nguyên tử giống Photpho đen, có khả năng dẫn nhiệt, dẫn điện nhưng giòn có thể nghiền thành bột dễ dàng.
As tồn tại ở các mức oxi hóa -3, +3, +5 với các hợp chất As(III) (Asenhidrua, Các Asenua kim loại,Asen(III) oxit – As2O3, Acid Asenous, Asensunfua: As4S6. Asentrihalogenua: AsX3) và hợp chất As(V) (Asen oxit : As2O5 ;Acid Asenic ;Asen Sunfua : As2S5 ; Asen Pentahalogenua : Chỉ có AsF5).
Nguồn gốc và chu trình của Arsenic trong tự nhiên
- Nguồn tự nhiên:
+ Quá trình nhiệt dịch, hoạt động của magma, hoạt động núi lửa ( quan trọng nhất),
+ Quá trình phong hóa, quá trình xói mòn, tạo quặng sulfur, đa kim, vàng,
+ Những quá trình bồi đắp phù sa, trầm tích hóa dẫn tới hình thành trầm tích chứa As trong các địa tầng
+ Quá trình khử hóa, hòa tan các khoáng chất giàu As trong đất vào nguồn nước ngầm.
- Nguồn nhân tạo:
+ Các quá trình xử lý quặng As, chiết xuất As từ các quặng …; nấu chảy kim loại ( đặc biệt là Cu), Pb, Zn, Ca, Sb, luyện kim
+ Chế tạo, sản xuất các hoá chất BVTV (thuốc trừ sâu, thuốc diệt cỏ, thuốc diệt côn trùng):
+ Trong kỹ nghệ thuộc da, chất làm khô và bảo quản gỗ;
+ Trong kỹ nghệ thủy tinh;
+ Khai thác nước dưới đất không khoa học;
+ Quá trình đốt các nhiên liệu hóa thạch, các chất thải rắn trong công nghiệp.
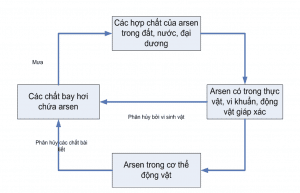
Chu trình Arsenic đơn giản
Đặc điểm và phân bố của Arsenic trong môi trường tự nhiên
Theo dự đoán, arsen hình thành do sự oxy hoá arsenopyrrit trong sét hoặc các lớp than bùn xen giữa chúng, hoặc do nước giàu arsen do các các đứt gãy cắt qua các vùng đá magma giàu arsen ở các vùng núi xa thấm vào tầng chứa nước dưới đất ở đồng bằng.
Khả năng ô nhiễm Arsenic ở vùng đồng bằng
- Arsenic trong trầm tích bở rời
- Arsenic trong nước ở các khu vực mỏ quặng giàu arsen
- Arsenic trong sinh vật
Dạng tồn tại hóa học của Arsenic trong môi trường
Các dạng tồn tại của As trong môi trường là vấn đề đáng quan tâm bởi vì có sự khác nhau về mức độ độc giữa chúng. Trong môi trường As tồn tại chủ yếu ở các dạng:
Arsenite As(III), arsenate As(V), arsenious acids (H3 AsO3 , H2AsO3 –, HAsO32–) arsenic acids (H3AsO4, H2AsO4–, HAsO42–), dimethylarsinate (DMA), monomethylarsonate(MMA), arsenobetaine(AB) và arsenocholine (AC).
Những dạng hợp chất này minh hoạ cho sự đa dạng của các trạng thái oxy hoá của As và kết quả là đưa đến sự phức tạp về hoá tính của nó trong môi trường.
Trong pha nước với môi trường thoáng khí acid, Arsenic chiếm ưu thế ở pH cực kỳ thấp (pH<2), trong khoảng pH từ 2 – 11 chúng được thay thế bởi H2AsO4– và HAsO42–.
Các con đường lây truyền của Arsenic
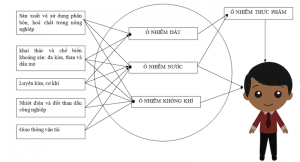
Các con đường lan truyền Arsenic
Theo các nghiên cứu những người sống trên khu vực có hàm lượng As trong nước giếng khoan cao hơn 0,05 mg/l cho thấy tới 20% dân cư bị xạm da, dầy biểu bì và có hiện tượng ung thư da. Hiện chưa có phương pháp hữu hiệu chữa bệnh nhiễm độc As.
Thông thường Arsen đi vào cơ thể con người trong một ngày đêm thông qua chuỗi thức ăn khoảng 1mg và được hấp thụ vào cơ thể qua đường dạ dày nhưng cũng dễ bị thải ra. Hàm lượng As trong cơ thể người khoảng 0.08-0.2 ppm, tổng lượng As có trong người bình thường khoảng 1,4 mg. As tập trung trong gan, thận, hồng cầu, homoglobin và đặc biệt tập trung trong não, xương, da, phổi, tóc. Hiện nay người ta có thể dựa vào hàm lượng As trong cơ thể con người để tìm hiểu hoàn cảnh và môi trường sống, như hàm lượng As trong tóc nhóm dân cư khu vực nông thôn trung bình là 0,4-1,7 ppm, khu vực thành phố công nghiệp 0,4-2,1 ppm, còn khu vực ô nhiễm nặng 0,6-4,9 ppm.
Sự nhiễm độc As còn gọi là Arsenicosis xuất hiện như một tai họa môi trường đối với sức khỏe con người trên thế giới. Các biểu hiện đầu tiên của bệnh nhiễm độc As là chứng sạm da (melanosis),dày biểu bì (keratosis), từ đó dẫn đến hoại thư hay ung thư da. Hiện chưa có phương pháp hữu hiệu chữa bệnh nhiễm độc As. Từ những năm 1970 và đặc biệt trong thập kỷ qua, nhiều tác động tiêu cực khác tới sức khỏe có liên quan đến việc phơi nhiễm As gia tăng. Có nhiều chứng cứ về những tác động này bao gồm bệnh về hệ mạch máu ngoại diên (chân đen).

– Qua da: Lớp da của chúng ta có khoảng 1% là lỗ chân lông và 5-10% nước vì vậy các As có thể thâm nhập qua da vào lớp hạ bì, chân bì và vào máu; Khi As thâm nhập vào bên trong sẽ phá hủy các tế bào, ngăn cản các quá trình sinh hóa của các tế bào, ức chế các tế bào hoạt động và từ đó làm biến đổi gen, gây ra ung thư
– Qua đường hô hấp: Phổi người có diện tích tiếp xúc với không khí là 40m2, ngoài ra có một mạng lưới mao mạnh với diện tích hơn 140m2; Dòng máu qua phổi thông qua các mao mạch này và tạo điều kiện thuận lợi cho sự hấp thu các chất ô nhiễm. Kết quả là làm tổn thương phổi: viêm nhiễm, kích thích, phù nề, xơ phổi, ung thư phổi …
– Qua màng ruột : Thâm nhập vào cơ thể thông qua thực phẩm, sau đó là sự hấp thu. Các hợp chất có độ phân cực thấp, ái mỡ thì nó sẽ tan vào trong mỡ, sau đó là khuyếch tán qua các màng mỡ để đi vào trong máu. Các ion kim loại có độ phân cực cao sẽ hòa tan trong dịch của màng ruột và tác động lên các tế bào.
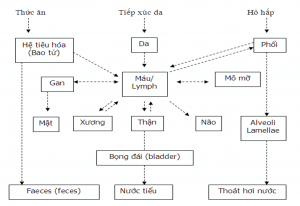
Cơ chế gây tác động của Arsenic trong cơ thể con người
As là một nguyên tố đặc biệt cần thiết ( khi ở hàm lượng rất thấp) và là chất độc cực mạnh (khi ở hàm lượng đủ lớn) đối với cơ thể con người và các sinh vật khác.
– Sự phơi nhiễm càng lâu và nồng độ arsen càng cao thì số lượng tế bào chết càng nhiều.
Cơ chế gây độc của arsen là nó tấn công vào các nhóm sulfurhydryl của enzym làm cản trở hoạt động của các enzym. Arsen (III) ở nồng độ cao làm đông tụ các protein do arsen(III) tấn công vào liên kết có nhóm sulfur. Khi vào trong cơ thể, đặc biệt là các As (III) tấn công ngay lập tức vào các enzym có chứa nhóm –SH và cản trở hoạt động của chúng.
Arsenat cũng giống như photphat, dễ kết tủa với các kim loại và ít độc hơn so với arsenit, vào cơ thể, Arsenat sẽ thế chỗ của photphat trong chuỗi phản ứng tạo adenozintriphotphat (ATP) – một chất có vai trò quan trọng trong trao đổi chất của tế bào – do đó ATP sẽ không được hình thành.
Khi có mặt của arsenat, tác dụng sinh hoá chính mà chính nó tạo ra đông tụ protein, tạo ra phức với coenzym và phá huỷ quá trình hoạt động photphat hoá để tạo ra ATP. Tóm lại, tác dụng hóa sinh chính của arsen là: làm đông tụ protein; tạo phức với coenzym và phá hủy quá trình photphat hóa tạo ra ATP.
Trong môi trường sinh thái, các dạng hợp chất As hóa trị (3) có độc tính cao hơn dạng hóa trị (5). Môi trường khử là điều kiện thuận lợi để cho nhiều hợp chất As hóa trị 5 chuyển sang As hóa trị 3.
Một số triệu chứng khi nhiễm độc Arsenic
– Nhiễm độc cấp tính:
+ Do hấp thụ chất độc Arsen qua đường tiêu hóa: triệu chứng thường gặp là rối loạn tiêu hóa( đau bụng, nôn, bỏng, khô miệng, tiêu chảy nhiều và cơ thể bị mất nước…) có thể dẫn đến tử vong.
+ Do hít thở không khí có bụi, khói hoặc hơi chứa As: Triệu chứng thường gặp: Rối loạn thần kinh như nhức đầu, chóng mặt, đau các chi. Rối loạn tiêu hóa thường xảy ra chậm so với trường hợp nuốt phải Arsen, với các biểu hiện buồn nôn, nôn, tiêu chảy, đau vùng bụng. Hiện tượng xanh tím mặt.Các tổn thương ở mắt như viêm da mi mắt, viêm kết mạc…
+ Khi da tiếp xúc với Arsen ; có thể gây ra viêm da tiếp xúc, viêm nang lông, loét…
– Nhiễm độc mãn tính : Xuất hiện các đốm sẫm màu trên thân thể hay ở đầu các chi, niêm mạc lưỡi hoặc sừng hóa da (thường xuất hiện ở tay, chân, phần cơ thể bị cọ sát nhiều hoặc tiếp xúc với ánh sáng nhiều), có thể gây đến hoại tử, rụng dần từng đốt ngón chân… cuối cùng sẽ có thể dẫn đến ung thư, đột biến gen và tử vong.
Nhận biết Arsenic trong đời sống hàng ngày
Tính chất của Arsenic
Arsen không gây mùi khó chịu khi có mặt trong nước, ngay cả khi lượng của nó có thể đủ làm chết người,nên khó có thể phát hiện bằng cảm quan. Vì vậy muốn biết mức độ ô nhiễm arsen trong nước ngầm ta có các cách sau:
– Lấy mẫu đem đến viện khoa học môi trường , cục địa chất và khoáng sản,các cơ sở y tê…phân tích
– Dò nước ô nhiễm Arsen bằng vi khuẩn phát sáng:
Nhóm nghiên cứu thuộc Viện Khoa học và Công nghệ môi trường Thụy Sĩ đã lợi dụng khả năng nhạy cảm với asen của vi khuẩn Escherichia coli để biến đổi gen sao cho chúng phát sáng khi dò thấy asen trong nước. Thành công trên có thể cứu sống nhiều người đang sử dụng nước ngầm bị ô nhiễm loại chất độc tự nhiên này. E.coli hiện cũng đang được thử nghiệm tại Việt Nam, chi phí thấp mà không bị giải phóng các hoá chất độc hại vào môi trường.
– Bộ kíp thử arsen :
Theo Tiến sĩ Trần Hồng Côn, Bộ môn Công nghệ hoá học, Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, không thể nhận biết được asen trong nước qua cảm quan. Kể cả nước trong và có cảm giác sạch vẫn có thể chứa chất độc này. Việc đun sôi và lọc vi trùng cũng không loại được asen, mangan và một số kim loại nặng khác.
Với bộ kit thử asen của Viện Địa chất, chỉ mất 7 phút để phát hiện có độc chất asen trong nước hay không. Bộ kít có có giá 150.000 đồng, thử được 25 lần. Với bộ kit này, có thể xác định được hàm lượng Asen trong nước từ 0,005mg/l đến 1,5mg/l
Bộ kit bao gồm một lọ phản ứng, một lọ giấy chỉ thị Asen, một lọ bột khử cho 25 lần thử, một lọ dung dịch As-1 và panh gắp. Tất cả được chứa trong một chiếc túi nhựa có kích cỡ bằng bàn tay. Người sử dụng chỉ cần đặt giấy chỉ thị vào nắp lọ phản ứng, đổ mẫu nước, dung dịch và bột khử vào lọ phản ứng theo chỉ dẫn rồi đậy chặt nắp lại. Nếu giấy chỉ thị chuyển sang màu vàng là biết nước có nhiễm asen.
Một số công nghệ xử lý Arsenic
Tạo kết tủa
Dùng dung dịch hóa chất, tạo các chất kết tủa nhờ các phản ứng hóa học với các ion tan trong dung dịch.
– Sắt thường tồn tại trong nước ngầm ở dạng hydrocarbonat hòa tan, khi gặp oxy, sẽ được oxy hóa tạo thành chất kết tủa, lắng đọng trong thời gian dài sẽ làm cho As có trong nước kết hợp lắng xuống đáy cùng với sắt.
- Ưu điểm
- Có thể xử lý triệt để và nhanh chóng Arsen
- Khuyết điểm
- Tiêu tốn nhiều hóa chất
- Có thể làm tắc nghẽn các công trình phía sau
- Ảnh hưởng đến chất lượng nước sau xử lý
Keo tụ
Phương pháp này bao gồm các phản ứng hóa học, quá trình hình thành các bông keo tụm phá vỡ độ bền vững hợp thể của các hạt chất bẩn, sự dính kết và tăng kích thước của các hạt chất bẩn trong nước cần xử lý … Phương pháp này thường được xử dụng dể tách cac hợp chất keo (kích thước 0.001-100 µm) và các hạt tán sắc lơ lửng trong nước (>100 µm).
Phương pháp keo tụ chuyển As từ dạng tan sang dạng không tan nhờ phản ứng hóa học, sau đó tách chúng ra khỏi nước nhờ lắng hoặc lọc.
Công nghệ thường sử dụng là: bổ sung thêm chất keo tụ như các muối của sắt hoặc nhôm, có thể oxy hóa sơ bộ và điều chỉnh pH. Trong công nghệ này, xử lý cặn thải chứa As từ quá trình keo tụ là một vấn đề đáng quan tâm.
Lắng
Tách pha rắn và pha lỏng nhờ tác dụng của trọng lực.
Phương pháp này thường được sử dụng kết hợp với tạo kết tủa và lắng.
Lọc
Phương pháp lọc thông thường được sử dụng để tách các chất rắn ra khỏi nước bằng cách cho nước đi qua khối vật liệu lọc bằng cát, than antraxit, than hoạt tính, vải lọc, giấy lọc. Những vật liệu này có tác dụng cho nước đi qua và giữ các chất bẩn trên bề mặt của chúng. Thông thường phương pháp này có thể tách các chất bẩn dạng hạt như bùn, sét, các hạt thể keo, các hạt nhỏ từ các chất hữu cơ trong tự nhiên, các hợp chất kết tủa của sắt và mangan, các bông keo tụ, vi khuẩn…
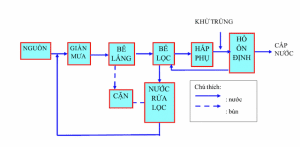
Quy trình lọc Arsenic
Hấp phụ
Với các nguồn nước có độ khoáng cao, phương pháp hấp phụ tỏ ra có hiệu quả do tính tương tác đặc thù của hệ. Vật liệu hấp phụ được sử dụng là một số oxít kim loại như nhôm, sắt, mangan, hay hỗn hợp các oxit kể trên. Arsen (dạng arsenat) hấp phụ trên các vật liệu oxit trên theo nhiều tác giả là theo cơ chế tạo ra phức chất bề mặt trên chất rắn. Theo đó, trước khi tạo ra liên kết hoá học chúng được hấp phụ và nó thường là giai đoạn chậm nhất của quá trình.
- Ưu điểm
- Ít bị ảnh hưởng nếu hàm lượng sunfate và cặn tan (nồng độ ion tổng)
- -Al2O3 có tính hấp phụ chọn lọc đối với các hợp chất của Asen
- Khuyết điểm
- Khó khăn trong việc tái sinh -Al2O3
Oxy hóa
Là phương pháp tương đối đơn giản, cho oxy tác dụng và chiếm lấy điện tử trong nguyên tử của chất phản ứng. Làm thoáng bằng cách sục không khí vào nước, tạo kết FeAssO4. Phản ứng oxy hóa quang hóa là phản ứng oxy hóa xảy ra trong hệ thống hóa học nhờ năng lượng bức xạ.
Oxy hóa và loại As bằng năng lượng mặt trời (SORAS):
Đây là quá trình xử lý As đơn giản trong cấp nước nông thôn từ nguồn nước ngầm, sử dụng phản ứng oxy hóa quang hóa As+3 thành As+5 nhờ ánh sáng mặt trời, sau đó tách As+5 ra khỏi nước nhờ hấp thụ bằng các hạt Fe+3. Phản ứng oxy hóa quang hóa được tăng cường hiệu suất nhờ nhỏ thêm vài giọt chanh hoặc nước vôi đặc, giúp cho quá trình tạo các bông keo Fe+3. SORAS có hiệu quả khi hàm lượng sắt trong nước ngầm ít nhất 3mg/L, cường độ bức xạ UV-A50Wh/m2.
Chưng cất bằng năng lượng mặt trời:
Phương pháp này xử dụng năng lượng mặt trời để làm bốc hơi nước, sau đó cho nước ngưng tụ lại. Quá trình bay hơi và ngưng tụ nước sẽ tách tất cả các chất, trong đó có cả As ra khỏi nước. Các nước ở vùng nhiệt đới, với nguồn năng lượng mặt trời sẳn có, phương pháp này có thể thích hợp, đặc biệt là ở các vùng ô nhiễm nặng. Có thể nghiên cứu áp dụng cho các vùng nông thôn nếu giải quyết được bài toán về hiệu quả kinh tế.
Lọc màng:
Sử dụng các màng bán thấm, chỉ cho phép nước và một số chất hòa tan đi qua để làm sạch nước. Công nghệ lọc màng cho phép có thể tác bất cứ loại chất rắn hòa tan nào ra khỏi nước, kể cả As.
Tuy nhiên phương pháp này thường rất đắt và do đó thường được sử dụng trong những trường hợp cần thiết, bắt buộc, khó áp dụng các phương pháp khác như khử muối, loại bỏ một số ion như As, … Có nhiều màng lọc được sử dụng như vi lọc, thấm thấu ngược, điện thẩm tách, siêu lọc và lọc nano.
Lọc bằng thực vật:
Đây là một công nghệ mới. Theo các nhà khoa học Mỹ, có thể làm sạch nước ô nhiễm thạch tín bằng cách trồng một loại cây dương xỉ mang tên Pteris vittata. Trong đó, trong vòng chưa đầy một ngày, cây sẽ hút As ra khỏi nước, làm mức kim loại độc này giảm xuống dưới ngưỡng an toàn do cơ quan27
Bảo vệ môi trường Mỹ (EPA) đặt ra. Đây là phương pháp mới rẻ tiền và loại dương xỉ trên sinh trưởng trong vùng khí hậu nóng ẩm giống như khí hậu ở nhiều vùng Châu Á. Không giống như phần lớn các phương pháp loại As khác, lọc As bằng thực vật không tạo ra bùn chúa nhiều As mà khó vứt bỏ. Ép nhựa dương xỉ có thể chiết xuất được 70% As dùng trong các mục đích công nghiệp.
Các kết quả nghiên cứu khác nhau cho thấy cỏ nến cả dòng Typha latifolia ở Bangladesh và dòng Typha orientalis ở Việt Nam đều có khả năng hấp thụ mạnh và nhanh arsen, nhờ đó làm giảm hàm lượng độc chất trong nước xuống dưới mức an toàn 0,01mg/lít. Ở miền Nam cỏ nến gọi là bồn bồn, thường thấy mọc hoang với chiều cao ít khi vượt quá 2 mét trông như cây sậy, đặc trưng bởi bộ hoa như hình cây nến mà ngành đông y khai thác dưới tên hương bồ, và bộ rễ cùng thân ngầm phát triển rất tốt nhất là ở nơi nước ngập lưu thông.
Tiến sĩ J.D. Jackson giới thiệu công trình thực nghiệm nhiều năm trên tờ Civil
Engineering tháng 4/2007, theo đó cỏ nến hút hết 89%, hàm lượng thạch tín trong nước giếng khoan chỉ còn trên dưới 38 microgram dùng được cho việc ăn uống.

Phương pháp Enzyme :
Nguyên tắc chung là dùng enzyme để xúc tác phản ứng chuyển hóa Arsenic (III) rất độc thành Arsenite(V) ít độc hơn hoặc chuyển hóa As dạng vô cơ sang dạng hữu cơ. Ví dụ: enzyme arsenate reductase từ chủng Alcaligenes faecalis xúc tác cho phản ứng chuyển hóa arsenite (III) thành arsenat (V).
Các tiêu chí lựa chọn công nghệ phù hợp:
- Chất lượng nước sau xử lý phải đạt yêu cầu sử dụng.
- Công nghệ đơn giản.
- Giá thành thấp.
- Không sử dụng hoặc yêu cầu điện năng tối thiểu.
- Có khả năng áp dụng cho các loại nguồn nước khác nhau, công suất cấp nước, quy mô phục vụ khác nhau.
- Sử dụng được các nguồn nguyên liệu, nhân công địa phương.
- Được cộng đồng chấp nhận
* Những phương pháp trên cần chi phí cao, công nghệ phức tạp, khó sử dụng trong các hộ gia đình. Ở quy mô hộ gia đình, có thể áp dụng các biện pháp để phòng tránh:
Giàn mưa làm bằng ống nhựa, đường kính 27mm, khoan 150-200 lỗ, mỗi lỗ có đường kính 1,5-2mm tuỳ công suất máy bơm đang sử dụng. Dưới cùng của bể lọc là lớp sỏi đỡ dày khoảng 1 gang, trên lớp sỏi đỡ là lớp cát dày khoảng 2,5-3 gang. Không dùng loại đệm lót giường, hoặc than củi dễ sinh phản ứng phụ, làm tăng nồng độ nitrit trong nước.
Nước từ vòi bơm rót vào máng mưa. Máng mưa cần có nhiều lỗ nhỏ để không khí dễ tan vào nước, phát huy hiệu quả oxi hoá của oxi có sẵn trong không khí. Sau khi qua máng mưa, nước cho chảy qua bể lọc có 3 ngăn: ngăn đầu dùng lọc cặn, nước thô chảy từ dưới lên; có đường xả cặn ở đáy, ngăn hai dùng lọc tỉnh, nước chảy từ trên xuống, ngăn thứ ba dùng chứa nước sạch. Kích thước tối ưu bể lọc phụ thuộc vào công suất, lưu lượng từng giếng. Trung tâm nước sạch và VSMT NT tỉnh Thái Bình đã sử dụng loại hình này từ lâu.
Các giải pháp quản lý của nhà nước với Arsenic
Chính quyền địa phương thường xuyên thống kê, rà soát tình hình các hộ dân sử dụng nước ngầm tại địa phương, định kỳ phối hợp với các đơn vị chức năng lấy mẫu phân tích, kịp thời phát hiện những thay đổi của nồng độ arsen trong nước ngầm để có biện pháp đối phó.
Nhà nước tăng cường quản lý đối với các lĩnh vực có phát sinh arsen: trong công nghiệp ( nhất là trong công nghiệp thủy tinh, gốm, thuộc da, thuốc nhuộm và chất màu để pha sơn), sử dụng phân bón và hóa chất bảo vệ thực vật.
Cảnh báo tác hại của việc sử dụng nước ngầm có chứa arsen đến sức khỏe con người, con đường thâm nhập của arsen, các biểu hiện nhiễm độc arsen để người dân cảnh giác thông qua các phương tiện truyền thông đại chúng, các buổi tuyên truyền.
Tăng cường công tác phát triển cấp nước sạch cho nhân dân, đảm bảo nồng độ của arsen trong chất lượng nước ăn uống theo đúng quy định của Bộ Y tế.
Phổ biến các kĩ thuật loại trừ Asen đơn giản, chi phí thấp, có thể áp dụng tại các vùng người dân hiện không có điều kiện sử dụng nước sạch và đang sử dụng nguồn nước ngầm chứa arsen


Bài viết liên quan
Download QCVN 01-1:2024/BYT – Quy chuẩn kỹ thuật quốc gia mới nhất về chất lượng nước sinh hoạt
1. QCVN 01-1:2024/BYT là gì? QCVN 01-1:2024/BYT là quy chuẩn kỹ thuật quốc gia do...
Tác hại của xả rác đối với môi trường và sức khỏe con người
Xả rác bừa bãi đã trở thành một vấn nạn nghiêm trọng, ảnh hưởng tiêu...
Than Hoạt Tính và Ứng Dụng Trong Xử Lý Nước Cấp Nước Thải
Than hoạt tính từ lâu đã được biết đến như một giải pháp hiệu quả...